 Blog
Blog
メダカ個体解析の論文初上梓ーMBoCの表紙を飾る
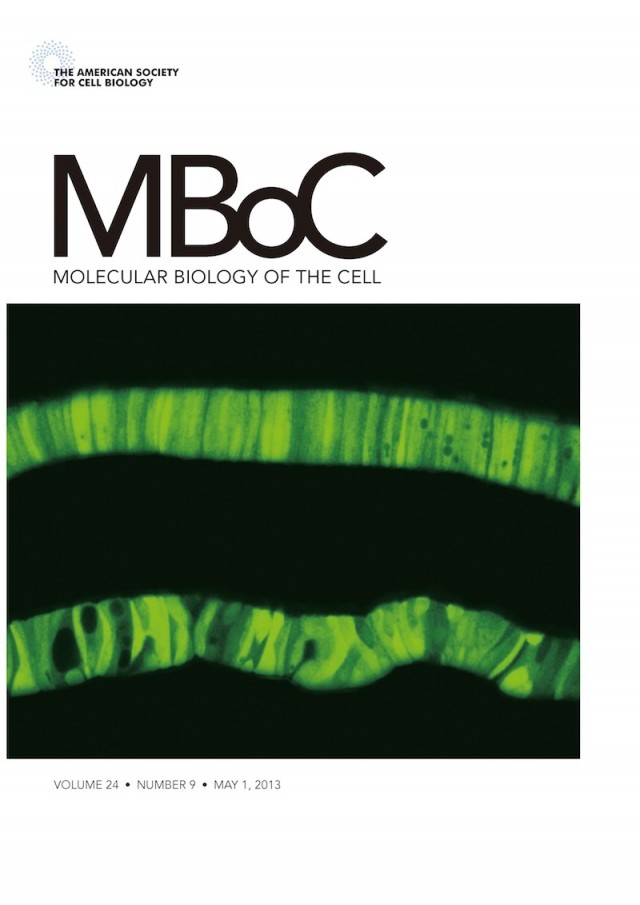 石川助教が6年の歳月を費やして完成させた、初のメダカ個体解析の論文が、米国細胞生物学会が発行する雑誌Molecular Biology of the Cell (MBoC) の5月1日号に掲載されました。しかもHighlight に選ばれ、右図のように表紙を飾りました (ホームページの不具合により、本日5月13日にアップしました)。
石川助教が6年の歳月を費やして完成させた、初のメダカ個体解析の論文が、米国細胞生物学会が発行する雑誌Molecular Biology of the Cell (MBoC) の5月1日号に掲載されました。しかもHighlight に選ばれ、右図のように表紙を飾りました (ホームページの不具合により、本日5月13日にアップしました)。
哺乳動物の小胞体ストレス応答では、IRE1・PERK・ATF6の3経路が機能していて、IRE1経路下流の転写因子XBP1のノックアウトマウスは肝臓の発達不全によって胚生致死となり、PERKのノックアウトマウスは生後糖尿病を発症しますので、小胞体ストレス応答が生理的に重要であることがわかります。ATF6経路(ATF6αとATF6βの2種類が存在)については我々自身でノックアウトマウスを作出し(とても大変でしたが)、ATF6αが小胞体シャペロンの転写誘導に必要であることを示しました。さらに、ATF6α・βそれぞれの単独ノックアウトマウスは表現型を示しませんでしたが、ATF6α・βダブルノックアウトマウスは胚生致死になりました(ATF6βがATF6αのバックアップの役割を果たしていると考えています)。ところが、E8.5という段階でお腹を開けても、ダブルノックアウトマウスが見当たらないので、3経路の中でATF6経路の破壊が最も重篤な表現型を示すことがわかりましたが、E8.5でいないと、死ぬのが早すぎて、我々の手では何が原因で死ぬのか究明することが困難でした。
そこで、母親の胎内で育つマウスと異なり、卵から孵化するメダカを使えば、初期発生過程を顕微鏡下で観察できるので、致死の原因がわかるのではないかと思って、メダカの解析を6年前に石川助教がM1だったときに開始しました。調べて見ると、期待通り、メダカでも上記3経路が機能しており(Ishikawa et al., CSF, 2011)、マウスの場合と同様にATF6α・βそれぞれの単独ノックアウトメダカは表現型を示しませんでしたが、ATF6α・βダブルノックアウトメダカは胚生致死になりました。
致死の原因を調べてわかったのは、ATF6α・βダブルノックアウトメダカでは脊索が発達しなかったのです。脊索は背骨ができる前に体の軸として働く重要な器官です。表紙を飾った写真の上は野生型の脊索で、円盤状の脊索鞘細胞が直線的にきれいに並んでいます。脊索鞘細胞は8型コラーゲンなどの細胞外マトリックスタンパク質を大量に合成分泌していて、細胞の外から自身を支えさせています。このとき、ATF6α・βが活性化され小胞体シャペロンが転写誘導されて、これらのタンパク質の品質が管理されているのです。一方下のATF6α・βダブルノックアウトメダカでは、小胞体シャペロンを転写誘導することができないために細胞外マトリックスタンパク質を十分に分泌することができなくなり、脊索鞘細胞のならびがガタガタになって(所々穴が見えますよね)、脊索の発達が止まることがわかりました。
実際に脊索が発達する段階では、生理的に小胞体ストレスが発生していて、モルフォリノを用いて8型コラーゲンをノックダウンすると、この小胞体ストレスが減じることがわかりました。つまり、8型コラーゲンを大量合成することが小胞体ストレスの原因であることを示すことができました。生理的小胞体ストレスの原因タンパク質を初めて同定することができたと自負しています。
表紙の写真は、小胞体シャペロンBiPのプロモーターを使って発現させたEGFPを観察しています。当然ながら、下のATF6α・βダブルノックアウトメダカではBiPプロモーターが活性化されていませんから、EGFPの発現量は低いです。脊索の形状比較のため、下は上に比べて20倍長い時間観察しています。
ツニカマイシンやタプシガルジンといった薬物を細胞に投与すると、強力に小胞体ストレスを起こすことができますので、小胞体ストレスの分野では、これらを安易に使った非生理的状況下の実験がまかり通っています。これらの薬物は小胞体ストレス応答3経路で働く分子の同定やシグナル伝達機構の解明においては必須の役割を果たしてきましたが、その体勢が判明した今、今後は薬物に頼らない、生理的もしくは病理的小胞体ストレスの研究を行って行かなければならないと思っています。目指せ、薬物依存からの脱却。


 電話:075-753-4067
電話:075-753-4067 Fax:075-753-3718
Fax:075-753-3718