研究内容
タンパク質の品質を管理する細胞応答(初学者・文系向け)
第26回(平成20年度)大阪科学賞 記念講演
「タンパク質の品質を管理する細胞応答」
森 和俊 氏 京都大学大学院理学研究科 生物科学専攻
生物物理学教室 ゲノム情報分野 教授
今回の講演タイトルは「タンパク質の品質を管理する細胞応答」ですが、品質管理といえば工場がやるようなことですね。それを細胞もやっているんだということがメインのお話となります。なるべく噛み砕いてお話して、「細胞はすごいことをしているんだなー。細胞や生き物を研究することは面白いことだなー」と思っていただければ幸いです。
まず基礎知識として「ゲノム」ということをわかっていただきたいと思います。ゲノムとは「ある生物種を規定する遺伝情報の総体」です。つまり、人が人になるための情報はヒトゲノム、ネズミがネズミになるための情報はネズミゲノムで、生物がある生物となるための情報をひっくるめてゲノムと呼びます。ゲノムは遺伝子よりも大きいまとまりで、遺伝子はゲノムの一部です。ゲノムという情報はどこに書き込まれているかというと、DNAです。ですから、ゲノムはDNAに書かれている全ての情報とも言えます。
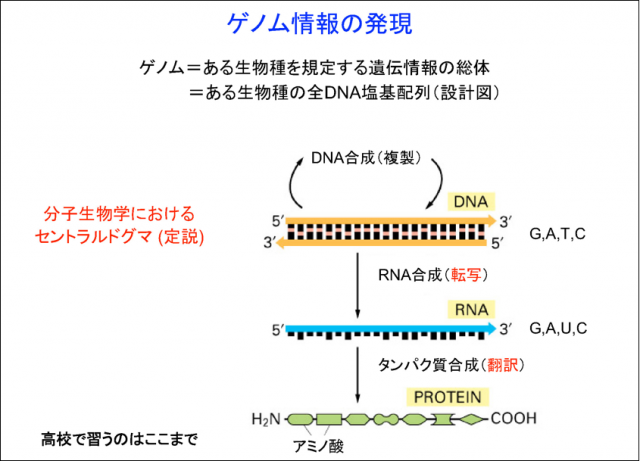 生物学にはセントラルドグマ(揺るぎない定説)というものがあります。DNAに遺伝情報が書き込まれていて、これが細胞の中で発現するときにはRNAというものに一旦なって(転写)、それからRNAが翻訳されてタンパク質ができます。現在高校で習うのはここまでですね(右図)。DNAというのは、G、A、T、Cという塩基が順番に並ぶ一次元の線のような情報になっていて、これをRNAに写し取っても同じ一次元の情報です。
生物学にはセントラルドグマ(揺るぎない定説)というものがあります。DNAに遺伝情報が書き込まれていて、これが細胞の中で発現するときにはRNAというものに一旦なって(転写)、それからRNAが翻訳されてタンパク質ができます。現在高校で習うのはここまでですね(右図)。DNAというのは、G、A、T、Cという塩基が順番に並ぶ一次元の線のような情報になっていて、これをRNAに写し取っても同じ一次元の情報です。
タンパク質はアミノ酸が繋がったもので、3つの塩基を1組の暗号として1つのアミノ酸が指定されます。ですから、タンパク質ができた時にはアミノ酸が連なった紐の状態です。しかしタンパク質は様々な形や大きさをしていて、紐のままでは役に立ちません。タンパク質がいろいろな役割を果たすためにはそれに適した三次元の形を取る必要があります。
紐だったものが針金細工のようにクルクルッとまとまって形を作らないと役に立たないのですが、タンパク質がどのようにして形を整えるのかについて、以前はあまり難しいことだと思われていませんでした。
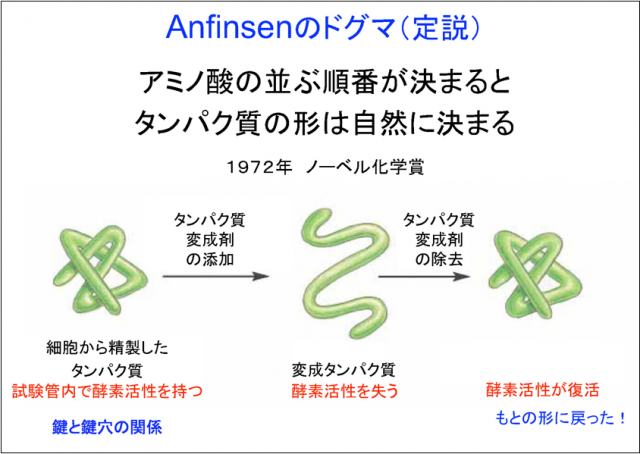 アンフィンゼンというノーベル賞を受賞した研究者が(右図)のような実験をして、「アミノ酸の並ぶ順番が決まると、タンパク質の形は自然に決まる」ということを発見したからです。細胞から精製した純品のタンパク質が酵素である場合、「鍵と鍵穴の関係」のように、特定の正しい形の時にだけ、酵素活性を発揮します。そこにタンパク質の形をおかしくする薬を入れると、酵素活性が失われてしまいます。しかし、一旦形がおかしくなった中から薬を取り除くと、再び酵素活性が戻ることをアンフィンゼン博士は発見しました。酵素活性が戻ったということは、タンパク質の形が元に戻ったということです。試験管の中にはタンパク質と水しかありませんので、そこにはアミノ酸の並ぶ順番の情報しかありません。そこで、アミノ酸の並ぶ順番が決まっていればタンパク質は自然に形をとることができると結論され、ノーベル賞をもらったので、これが定説となっていました。
アンフィンゼンというノーベル賞を受賞した研究者が(右図)のような実験をして、「アミノ酸の並ぶ順番が決まると、タンパク質の形は自然に決まる」ということを発見したからです。細胞から精製した純品のタンパク質が酵素である場合、「鍵と鍵穴の関係」のように、特定の正しい形の時にだけ、酵素活性を発揮します。そこにタンパク質の形をおかしくする薬を入れると、酵素活性が失われてしまいます。しかし、一旦形がおかしくなった中から薬を取り除くと、再び酵素活性が戻ることをアンフィンゼン博士は発見しました。酵素活性が戻ったということは、タンパク質の形が元に戻ったということです。試験管の中にはタンパク質と水しかありませんので、そこにはアミノ酸の並ぶ順番の情報しかありません。そこで、アミノ酸の並ぶ順番が決まっていればタンパク質は自然に形をとることができると結論され、ノーベル賞をもらったので、これが定説となっていました。
試験管内ではそのようになるのですが、細胞の中でも本当にそうかというと実際はちょっと違うぞということがわかりだしたのが80年代頃からのことで、そこから細胞内での研究がはじまりました。
少し話が専門的になりますが、20種類あるアミノ酸は水に親しむものと、水を疎んじるものの2つに分けることができます。細胞の中は70%が水ですから、タンパク質の外側には水に親しむアミノ酸が存在し、内側に水を疎んじるアミノ酸が集まるのが普通です。
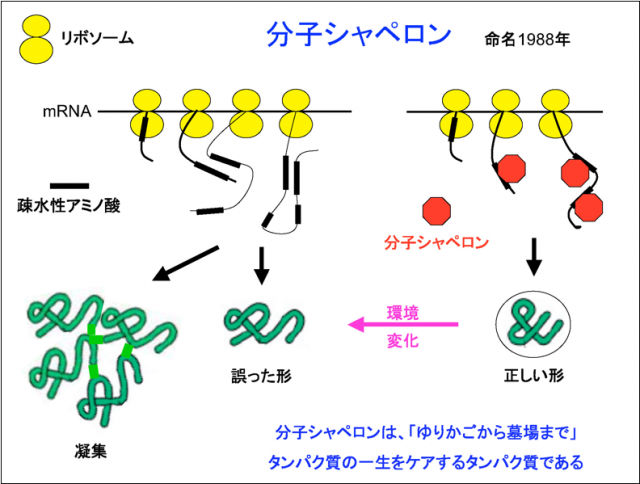 一方、細胞の中には非常に多くのタンパク質が、混み合って存在しています。タンパク質はダルマ型のリボソームというものの中で作られますが、その周りがタンパク質でいっぱいだと、疎水性アミノ酸は水に馴染まない分互いにくっつきやすい性質を持っているので、放っておくと変な形になってしまうということがわかってきました。それでは困りますので、実際に細胞はどうしているかといいますと、細胞は「分子シャペロン」というタンパク質の形を整える特殊なタンパク質を用意しています。分子シャペロンは疎水性のアミノ酸にくっついて、それらが誤った相互作用をしないようにするのです(右図)。
一方、細胞の中には非常に多くのタンパク質が、混み合って存在しています。タンパク質はダルマ型のリボソームというものの中で作られますが、その周りがタンパク質でいっぱいだと、疎水性アミノ酸は水に馴染まない分互いにくっつきやすい性質を持っているので、放っておくと変な形になってしまうということがわかってきました。それでは困りますので、実際に細胞はどうしているかといいますと、細胞は「分子シャペロン」というタンパク質の形を整える特殊なタンパク質を用意しています。分子シャペロンは疎水性のアミノ酸にくっついて、それらが誤った相互作用をしないようにするのです(右図)。
「シャペロン chaperone」とは若い婦人が社交界に出る時の付き添いという意味の言葉です。西洋のお嬢様が社交界デビューするとき、初めてだとどうしていいか解らず困りますよね。そこで年配のご婦人が付いて、今はどうする時ですよと教えてあげるのです。放っておくと誤った行動をするかもしれないので、近くにいて助けてあげるというところから、分子シャペロンという名前になりました。
また、タンパク質は一旦形が良くなればずっとそのままという訳でもなく、熱などの環境変化によっても変な形になることがあります。ですから分子シャペロンは、タンパク質の一生を通じてケアをすることになります。
ここで一旦まとめますと、タンパク質の高次構造形成つまり形作りとは、一次元の情報を三次元の情報にするということで、ゲノム情報が細胞の中で発現するときにおける、最後の難関であると考えています。
こういうことで、タンパク質の形作りが難しい大事な問題だということがわかりました。では、タンパク質はどこで形を整えるのか、これが次の問題となりました。
例えば細胞の外側表面には受容体という情報を受け取るタンパク質が存在し、細胞の外を流れる様々な情報の中から、これも鍵と鍵穴の関係でカチッとはまるものだけを受け止めて、核というDNAがある場所に伝えます。もし受容体が、働く場所である細胞の表面で形を作ったらどうなるでしょうか。形作りは難しい作業ですから時間がかかったり進まなかったりします。形作りが途中でまだ正しい形でない受容体が存在した場合、鍵と鍵穴の関係が上手くいかず、必要な情報を取り逃したり、逆に誤った情報を偶然伝えたりする恐れも出てきて、良くありません。働く場所で形を作るのにはいろいろ問題があります。
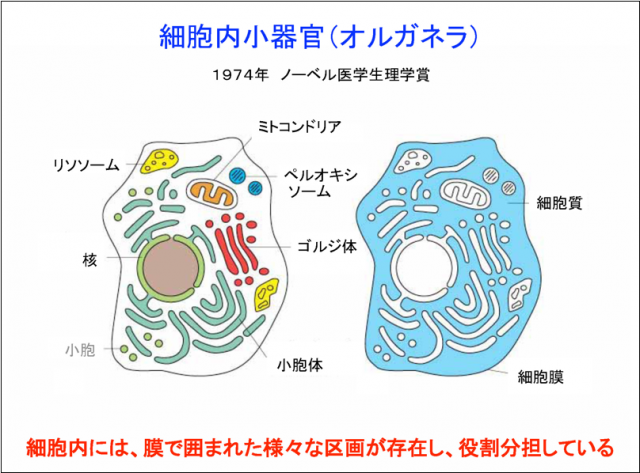 ではどこで形を作るのか、生物の基礎知識に戻るために(右図)をご覧ください。細胞は自分の外と内を分けるために膜で囲われていて、中を水が70%くらい満たしているのですが、その中に膜で囲まれた様々な区画が存在していて、役割分担をしています。これらを細胞内小器官(オルガネラ)と言います。例えばミトコンドリアはATPというエネルギーを作り、リソソームは古いものを分解してリサイクルします。細胞内でのタンパク質の形作りで重要なのは小胞体という区画です。
ではどこで形を作るのか、生物の基礎知識に戻るために(右図)をご覧ください。細胞は自分の外と内を分けるために膜で囲われていて、中を水が70%くらい満たしているのですが、その中に膜で囲まれた様々な区画が存在していて、役割分担をしています。これらを細胞内小器官(オルガネラ)と言います。例えばミトコンドリアはATPというエネルギーを作り、リソソームは古いものを分解してリサイクルします。細胞内でのタンパク質の形作りで重要なのは小胞体という区画です。
受容体やホルモンなどの場合、リボソームからアミノ酸ができてきて最初に出会う細胞内小器官が小胞体でして、一番初めに出会う場所でタンパク質の形作りが行われているのです。
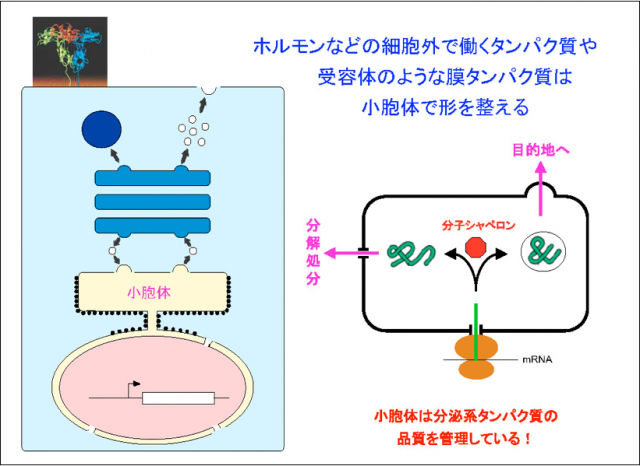 小胞体を拡大したのが(左図右側)ですが、この中には分子シャペロンが沢山入っていて、その働きのおかげで良い形のタンパク質ができ、これが目的地(細胞表面など)へ行って働くということがわかってきました。
小胞体を拡大したのが(左図右側)ですが、この中には分子シャペロンが沢山入っていて、その働きのおかげで良い形のタンパク質ができ、これが目的地(細胞表面など)へ行って働くということがわかってきました。
一方、工場と同じように、中には不良品のタンパク質もできます。これをそのまま送り出すと問題になりますが、小胞体は不良品を判別して、使われないように壊してしまいます。いいものは出荷して使い悪いものは壊す、まさに小胞体はタンパク質の品質を管理する工場の働きをしていることがわかりました。
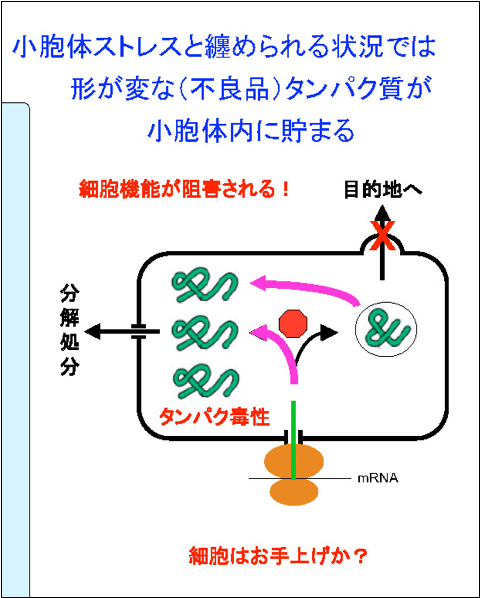 普段はこのような状況ですが、細胞はさまざまな環境変化にさらされますので、時には内部がおかしくなるときがあります。これを我々は小胞体ストレス、小胞体に負荷が掛かった状態と言います。そうなると、良いものを作ろうとしても悪いものができることの方がずっと多くなる、あるいは良いものが悪いものに変わってしまうといった事も起こり、変な形のタンパク質が小胞体内にいっぱい溜まってきます。こうなると細胞は良い形のタンパク質を出荷できなくなって困ります。また、悪いタンパク質が毒性を発揮するといった問題も起こります。
普段はこのような状況ですが、細胞はさまざまな環境変化にさらされますので、時には内部がおかしくなるときがあります。これを我々は小胞体ストレス、小胞体に負荷が掛かった状態と言います。そうなると、良いものを作ろうとしても悪いものができることの方がずっと多くなる、あるいは良いものが悪いものに変わってしまうといった事も起こり、変な形のタンパク質が小胞体内にいっぱい溜まってきます。こうなると細胞は良い形のタンパク質を出荷できなくなって困ります。また、悪いタンパク質が毒性を発揮するといった問題も起こります。
では、こうなったら細胞はお手上げかというと、こういう時でもきちんと対応する術を持っていることがわかりました。この対応策が、私がこれまで行ってきた研究です。
どうするのかというと、小胞体内部に変な形のタンパク質が溜まってくると、その情報を小胞体がキャッチして、核にその情報を伝令のように伝達します。そこで何をするかというと、ある遺伝子群の転写を活性化して、分子シャペロンをたくさん作るようにします。分子シャペロンの数を増やして、小胞体の中の、タンパク質の形を整える能力をアップさせるのです。また変な形のタンパク質を分解処分するための「引き抜き装置」の量も増やして、タンパク質の分解能力もアップさせます。細胞内にはこのような仕組みが備わっていることがわかってきました(下図)。
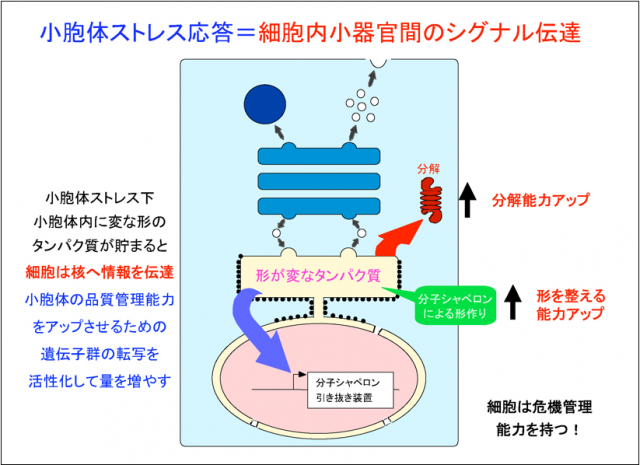
こうして見ていくと、細胞はなかなか凄いことをしています。まずはタンパク質の品質管理を行っています。そして、その品質管理に危機が訪れると、ちゃんと危機管理能力を発揮し、悪いときにはそれなりに対応できるような仕組みを持っています。こういったことを覚えて帰っていただければと思います。
私は、どのようにして小胞体が情報を捕まえて、核という別の所へ情報を送っているのかという仕組みを研究しました。まずは出芽酵母で研究して、その仕組みを明らかにしました。単細胞生物で明らかになったので、次はより複雑な、哺乳動物での仕組みを明らかにしました。これ以上は難しすぎるので省略しますが、哺乳動物は進化している分だけ酵母で行われるよりも、もっと複雑で巧みな仕組みを使って分子シャペロンや引き抜き装置を増やしていることがわかり、このような研究内容が受賞の対象となりました。
私の研究分野の新しいところはどこかと申しますと、受容体などを使った細胞表面からの情報伝達はずっと前から研究されてきたのですが、今回わかったような、細胞内小器官、細胞の中の区画同士の間でもコミュニケーションをとっているということ、これが新しいところではないかと思います。
森研究員 生化学会奨励賞受賞
HSP研究所主任研究員の森和俊氏が「小胞体から核への細胞内情報伝達機構 Unfolded Protein-Response の解析」で日本生化学会奨励賞を受賞しました。
吉田研究員 生化学会奨励賞受賞
さきがけ研究員の吉田秀郎氏が「高等動物の小胞体ストレス応答の分子機構」で日本生化学会奨励賞を受賞しました。
森教授 2005 ワイリー賞受賞
http://www.wiley.com/legacy/wileyfoundation/
 平成17年 1月26日ニュージャージー州ホボケン市において、ワイリー財団会長であり、1807年創業の出版社「ジョン・ワイリーと息子達」の副社長であるデボラ・ワイリー氏は、第4回ワイリー医学生物科学賞の受賞者を発表した。
平成17年 1月26日ニュージャージー州ホボケン市において、ワイリー財団会長であり、1807年創業の出版社「ジョン・ワイリーと息子達」の副社長であるデボラ・ワイリー氏は、第4回ワイリー医学生物科学賞の受賞者を発表した。
「第4回ワイリー医学生物科学賞が、ピーター・ウオルター博士(ハワード・ヒューズ医学研究所研究員兼カリフォルニア大学サンフランシスコ校教授・生化学生物物理学科長)と森和俊博士(京都大学大学院理学研究科生物物理学教室教授)に贈られますことを謹んで発表します。この名誉の一部として、ウオルター博士と森博士は平成17年4月8日にニューヨーク市のロックフェラー大学で受賞講演を行うよう招聘されました。」
 「本年のワイリー賞は、正しい高次構造をとった分泌タンパク質を産生することができるように細胞が、自らの細胞内小器官の能力を調節するという全く新しい経路をウオルター博士と森博士が発見したことに対して贈られた」とワイリー賞の選考委員会議長であるグンター・ブローベル博士は述べた。ロックフェラー大学細胞生物学科教授であるブローベル博士は1999年のノーベル医学生理学賞受賞者である。他に、カリフォルニア工科大学の発生神経学者デイビッド・アンダーソン博士、コロンビア大学の生理学者カイス・アルアカティ博士、エール大学の分子生物学者ジョアン・スタイツ博士が選考委員を務めた。
「本年のワイリー賞は、正しい高次構造をとった分泌タンパク質を産生することができるように細胞が、自らの細胞内小器官の能力を調節するという全く新しい経路をウオルター博士と森博士が発見したことに対して贈られた」とワイリー賞の選考委員会議長であるグンター・ブローベル博士は述べた。ロックフェラー大学細胞生物学科教授であるブローベル博士は1999年のノーベル医学生理学賞受賞者である。他に、カリフォルニア工科大学の発生神経学者デイビッド・アンダーソン博士、コロンビア大学の生理学者カイス・アルアカティ博士、エール大学の分子生物学者ジョアン・スタイツ博士が選考委員を務めた。
全ての細胞は、自らが分泌し、また細胞表面に提示するタンパク質が正しく構成され機能的であるよう万全を尽くさなければならない。 'Unfolded Protein Response'と呼ばれる細胞内情報伝達機構に関する先駆的な仕事により、森博士とウオルター博士は、細胞が、自らが持つタンパク質の高次構造形成能力と品質管理能力を必要に応じて調節するための分子機構を明らかにした。彼らの業績は、どのようにして細胞は細胞内小器官の分量を正しく保つのかという基本的な疑問に対する答えを出しただけでなく、特殊な細胞型の分化あるいはタンパク質の折り畳み異常病や癌などを含む様々な病気の発症に対する我々の理解にも貢献している。
ワイリー医学生物科学賞は、新しい研究分野開拓への貢献、もしくは、ある特定の医学生物学的原理における新しい概念創出や応用方法開発への貢献を顕彰するため創設された。この賞は、顕著なリーダーシップと革新を証明し得る一つの明確な貢献もしくは一連の貢献を賛えるものである。賞金として総額2万5千ドルが贈られ、授賞式の場であるロックフェラー大学において公開形式の講演を行なう機会が与えられる。
授賞式
授賞式の写真はギャラリーでご覧ください。
過去の受賞者
第1回(2002年度)アポトーシスの分子遺伝学的解析
ロバート・ホルヴィッツ博士(マサチューセッツ工科大学)
スタンレー・コルスメヤー博士(ダナ・ファーバー癌研究所)
第2回(2003年度)Small interfering RNAs (siRNA) の発見
アンドリュー・ファイアー博士(ジョンズ・ホプキンス大学)
クレイグ・メロー博士(マサチューセッツ大学医学部)
トーマス・タシュル博士(ロックフェラー大学)
デイビッド・ボールコム博士(英国サインスベリー研究所)
第3回(2004度)転写制御におけるヒストン修飾の発見
デイビッド・アリス博士(ロックフェラー大学)
と錚々たる顔ぶれが並ぶ。特に、第1回のホルヴィッツ博士は、受賞後その年にノーベル医学生理学賞を受賞した(と言うことは、もしかして・・・???)。
裏話
平成16年11月25日(木)、いつものように出勤すると、
--------------------------------------------------------------------------------------------------------
Dear Dr. Mori,
I would very much like to speak to you on the phone. Could you please give me your home and lab number and tell me what would be a good time to call you?
Thank you!
Best regards,
Guenter Blobel
---------------------------------------------------------------------------------------------------------
という電子メールが届いており、何かまずいことしたかなあ、と訝りながら取り敢えず返信したところ、一日間を挟んで土曜日の朝9時頃ブローベル博士から電話がかかってきました(その日は私がJournal Clubの担当日で、いつもよりかなり朝早くラボに行って詰めの作業をしていたので、幸運にも受けることができました)。手短な挨拶の後、ホニャララ賞の受賞者にピーター・ウオルターとあなたが決まった、おめでとうと言われ、ホニャララ賞の説明を受けました。当時の私は、ワイリー賞というものの存在すら知らなかったので、何賞と言っているのかは聞き取れなかったけど、比較的最近創設された賞で、最初の受賞者のホルヴィッツ博士はその後すぐノーベル賞をもらったとか、次の受賞者がsiRNAの発見者達で、その年の受賞者がヒストン・コードの発見者であると言うことはわかったので、凄い賞だというのは理解しました。来年の4月8日にニューヨークのロックフェラー大学で授賞式と受賞講演を行なうけど来ることができるかと聞かれたので、勿論行きますと言って電話を切りました。
内心は興奮していたけど、10時から私のJournal Clubの発表とラボメンバーのProgress Reportsをこなした後(当時は土曜日朝10時からセミナーをやっていました)、若い方から順番にグンター・ブローベルって何をした人か知っているかと聞くとマスター以下は全滅。ドクターの学生になってやっとシグナル説がでてきましたので、実は今朝そのノーベル賞受賞者から直接電話があって、ホニャララ賞をくれると言われたと電話内容を伝えると、皆喜んでくれました。
UPRの重要性が世界的に認められ、私および吉田氏を中心としたラボの貢献を高く評価してくれたことを素直に喜びたいと思います。
« 前のページ 次のページ »

 電話:075-753-4067
電話:075-753-4067 Fax:075-753-3718
Fax:075-753-3718