研究内容
分泌系タンパク質のフォールディング異常に対して小胞体が示す3つの応答
タンパク質のフォールディングは分子シャペロンにより積極的に介助され、実際小胞体にも多種多様な分子シャペロンが存在しています。また分泌系タンパク質の多くは、小胞体を通過するタンパク質のみに特徴的な化学修飾 (糖鎖の付加やジスルフィド結合の形成) を受けます。このような化学修飾を触媒する酵素 (フォールディング酵素) によってもフォールディングは促進されます。これら小胞体内の分子シャペロンや酵素類(これらをまとめて小胞体シャペロンと呼びます)は一般に、恒常的にかなり高いレベルで発現されているし、小胞体内の環境もフォールディング効率が良く進行するように調整されています。
しかしながら、どんなに周到に用意していても、タンパク質が変性したり、新規に合成されたタンパク質がきちんとした立体構造を形成することができなくなってしまう事態が時として起こり得ます。生卵をゆでればタンパク質が変性し固まることはよく知られていますが、タンパク質の変性は高温に曝された時にだけ起こるのではなく、ヒ素や重金属のような有害な物質が環境に添加されても誘起されます。また脳梗塞や心筋梗塞のような虚血性疾患によっても発生します。
また、分化の過程で、小胞体の品質管理能力を超える量のタンパク質が小胞体に送り込まれれば、高次構造形成が十分行われず、結果的に不良品タンパク質が生じてしまいます。
このようないわゆる小胞体ストレス条件下で、高次構造が異常になった不良品タンパク質が小胞体内に蓄積するという異常事態が発生した場合に、何も対処できなければ細胞は生存することができません。なぜなら、不良品となった分泌系タンパク質は小胞体にとどめられるため、細胞が必要とするタンパ ク質を必要とされる場所へ運ぶことができないからです。また、不良品タンパク質は凝集しやすく、いわゆるタンパク毒性を発揮してしまいます。
そこで、小胞体の恒常性を維持するために細胞は以下の3つの応答反応を行います。
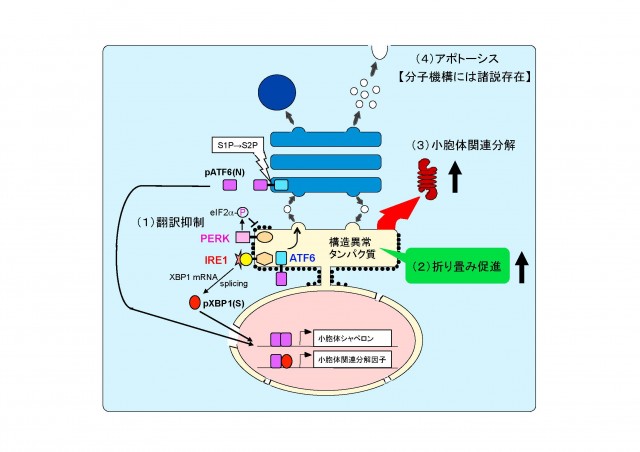
- 翻訳を抑制して、新生タンパク質がそれ以上小胞体内へ送り込まれないようにし、小胞体内の負荷を軽減する(上図, Attenuation: 翻訳抑制)。小胞体ストレスセンサー PERK が翻訳開始因子 eIF2-a をリン酸化することによって翻訳が一時的に停止します。
- 小胞体シャペロンを誘導して小胞体内のフォールディング容量を増大させ、不良品タンパク質の修復に努める(上図, Induction: 転写誘導による巻き戻し促進)。小胞体ストレスセンサー ATF6 がゴルジ体へ移行し、S1P と S2P による連続切断を受け、その細胞質側領域が核へ移行して活性型の転写因子 pATF6(N) として働き、小胞体シャペロンを転写誘導します。
- 不良品タンパク質を小胞体から引き抜く装置を転写誘導し、引き出されたタンパク質をサイトゾルでユビキチン化し、26S プロテアソームにより分解する(上図, Degradation: 転写誘導による分解促進)。小胞体ストレスセンサー IRE1 が下流の転写因子をコードする XBP1 mRNA のスプライシング反応を開始し、生じた活性型の転写因子 pXBP1(S) が pATF6(N) とヘテロダイマーを形成して、小胞体関連分解構成因子を転写誘導します。
これらの応答は纏めて UPR (Unfolded Protein Response) または小胞体ストレス応答 (ER Stress Response) と呼ばれています。
 電話:075-753-4067
電話:075-753-4067 Fax:075-753-3718
Fax:075-753-3718